The first application of cathodic protection (CP) can be traced back to 1824, when Sir Humphry Davy, in a project financed by the British Navy, succeeded in protecting copper sheathing against corrosion from seawater by the use of iron anodes. (reference)
About 1820 the Navy Board was anxious to find the reason why copper sometimes got fouled, whilst iron was dissolving, and at other times the copper was dissolving rather too quickly. A Committee was formed with the Royal Society, of which Sir Humphry Davy was President. Davy had already in 1806 advanced the hypothesis that chemical and electrical charges may be identical, and later convinced Berzelius of this idea. Now, assisted by Michael Faraday, he began to experiment with copper and other metals, such as iron and zinc in various saline solutions, and found the electrochemical reactions he had expected. Sir Humphry Davy advocated a small quantity of zinc, or of even cheaper malleable iron, should be placed in contact with copper, and thereby prevent its corrosion.
Metalen beschermen aan boord
- Hoe doen we dit ?
- Wat zijn de externe invloeden ?
- Hoe meten we dit op?
Corrosie van metalen vermijden
- Door het toevoegen van een anode ( Zinc, Aluminium, Magnesium ) creëren we een speciale galvanische cel.
- Naast anodes wordt er, in de professionele vaart, spanning en stroom toegevoegd. (ICCP)
Wat zijn de oorzaken van corrosie?
- Natuurlijke corrosie ten gevolge van de werking van een galvanische cel
- Corrosie ontstaan door gewilde toegevoegde stroom (ICCP)
- Corrosie ontstaan door ongewilde toegevoegde stroom ( zwerfstromen ) die als katalysator werken op de chemische reactie ontstaan in de galvanische cel
Definities van stoffen.
Vaste stoffen – Gasvormige stoffen – Vloeibare stoffen
Al deze nemen plaats in en hebben een massa
Materie bestaat uit atomen & of atomen + moleculen
- Een element is materie die niet kan gewijzigd worden door een chemisch proces bv Cu, O,
- Elementen zijn opgebouwd uit atomen
- Moleculen zijn combinaties van atomen

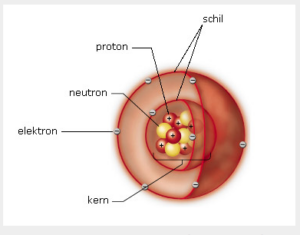
De opbouw van een atoom
Een atoom is opgebouwd uit elementaire deeltjes zijnde:
- Protonen, deze zijn positief geladen +
- Neutronen, deze zijn neutraal n=0
- Electronen, deze zijn negatief geladen –
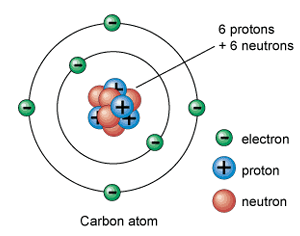
De neutronen en de protonen bevinden zich in de KERN van het atoom.
De electronen bewegen in schillen ronde de kern van het atoom.
Er zijn evenveel protonen als dat er electronen zijn, we spreken van evenwicht.
Een atoom is dus NEUTRAAL
Het MASSAGETAL van een atoom is gelijk aan het aantal protonen + het aantal neutronen.
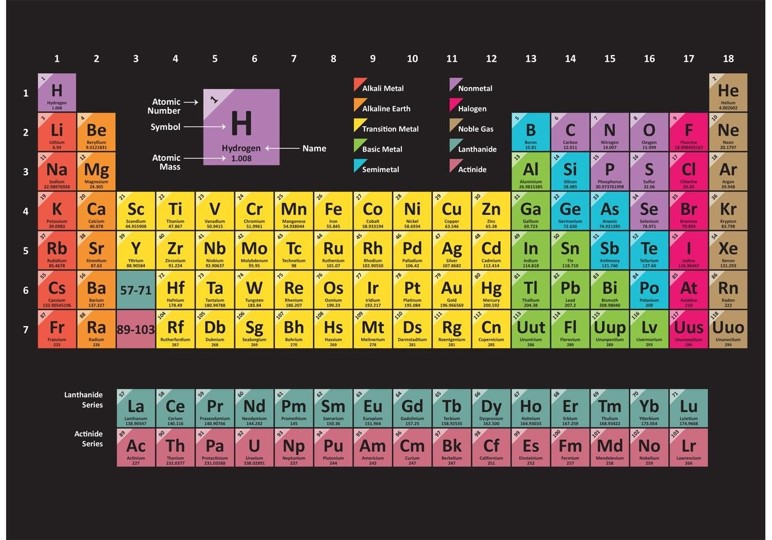
We vinden deze gegevens terug in de periodieke tabel of de tabel van Mendlejev
Waarom hebben we dit nu allemaal nodig?
Op ons yacht komen we, in aanraking met zeewater – of zoetwater, een aantal metalen tegen.
Dit kunnen allen gelegeerde metalen zijn met verschillende samenstellingen.
Er bestaan in de markt bijvoorbeeld een aantal soorten maritiem brons, daarnaast hebben we ijzer, inox, koper, lood, zinc, aluminium.
Met al deze metalen kan een galvanische cel gevormd worden.
We komen echter op een yacht veel koper en koperlegeringen tegen en we gebruiken veelvuldig zink anodes.
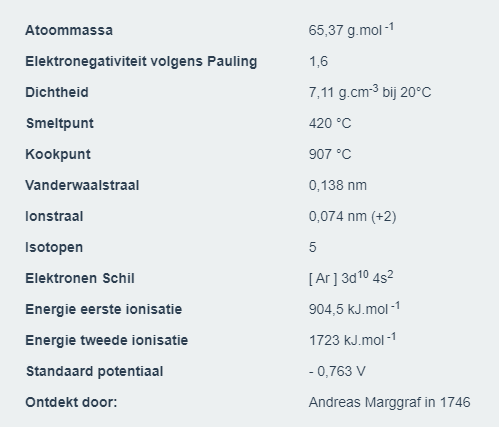
Hieronder waarden uit de periodieke tabel.
Sommige hebben we nodig, zoals deze van koper en zink.
Koper

Zink
IONEN, een nieuw begrip
Als een atoom 1 of meer elektronen opneemt of afgeeft is het niet meer neutraal en wordt het een ion genoemd. Ook dit begrip is nodig om de ionenstromen en de elektronenstromen te begrijpen.
Elektronen bevinden zich op schillen rond een kern. De manier waarop ze zich verplaatsen ( elektrische stroom ) is verschillend tussen metalen en niet metalen.
METALEN
- Leegmaken van de buitenste schil ( afgeven van elektronen e- )
- De onderliggende schil wordt de buitenste schil
- We spreken nu van positieve ionen of KATIONEN
NIET METALEN
- Aanvullen van de buitenste schil ( opnemen van elektronen e-)
- We spreken nu van negatieve ionen of ANIONEN
ION bindingen: tussen Anionen en Kationen
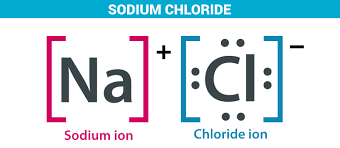

Anionen en Kationen trekken elkaar aan
Een ionverbinding is een verbinding waarin de samenstellende delen ionen zijn, bijvoorbeeld zout NaCl een rooster als een kristal met rechte vlakken. NaCl is oplosbaar in water.
Ionbinding Ag/AgCl
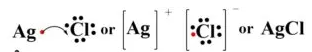

2 halfcellen vormen een cel
2 halfcellen vormen een galvanische cel.
De ionbinding Ag/AgCl is onoplosbaar in water en wordt gebruikt als een REFERENTIE HALFCEL,
Mogelijke bindingen met meer of minder Cl waardoor er verschillende Ag/AgCl halfcellen bestaan in de handel.
Wat is OXIDATIE, een nieuw begrip.
Oxidatie van een atoom is de verwijdering van elektronen e-
Het Oxidatiegetal is het aantal elektronen dat een atoom zou krijgen of verliezen
Voorbeeld: Het oxidatiegetal van koper is Cu 2+
2 negatieve elektronen zijn verwijderd uit de buitenste schil zodat het ion + wordt
Voorbeeld: Het oxidatiegetal van zink is ZN 2+
Om de werking van de anode op het schip te begrijpen, dienen we enkel de elektronen stromen en de richting die ze uitgaan te begrijpen.
We spreken over een conventionele stroom en over een werkelijke stroom. Meer hierover verder…..
IONEN in zeewater
99 % van alle zeezouten
Zeewater is positief geladen
Samenstelling van zeewater
Cl-
Na+
SO4 2-
Ca 2+
K +
Niet alle waters zijn gelijk
NOORDZEE
BALTISCHE ZEE
Verschillen worden veroorzaakt door onder andere:
<> ZUUR
<> ZUURSTOF
<> STROMING
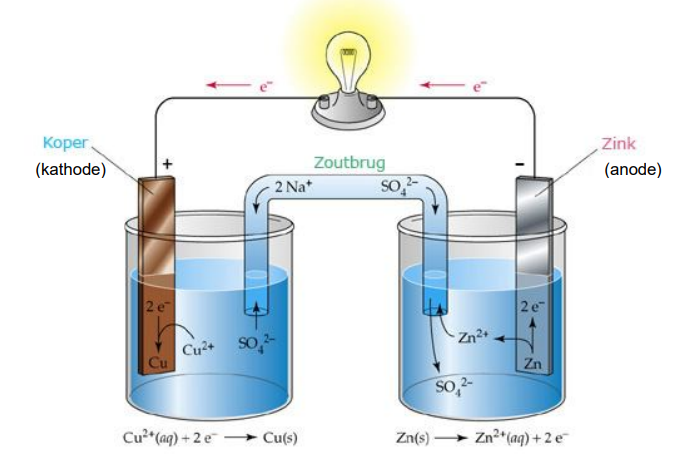
De GALVANISCHE CEL
Welke metalen oxideren het meest Fe2+…Fe3+ ?
Principe van een galvanische cel
Elektronen stroom en Ionen stroom
De metalen in contact met zeewater verliezen ionen aan het zeewater.
- Elektronen blijven achter op het metaal.
- Het zeewater is de zoutbrug.
- De metalen bouwen een elektronen potentieel op.
- Voor elk soort metaal is dit verschillend.
- Het elektrolyt of de ionenoplossing is ook verschillend, zeewater, brak water, zoet water
Metalen zullen niet allen op dezelfde wijze, in dezelfde mate, oxideren, dat is het teruggeven van elektronen aan het zeewater.
Er zijn edelere en minder edelere metalen

Hoe verder de metalen uit elkaar liggen, hoe groter de corrosie activiteit.
Magnesium verbonden met Platinium roest sneller dan verbonden met koper.
Het meer actieve metaal noemt men de ANODE.
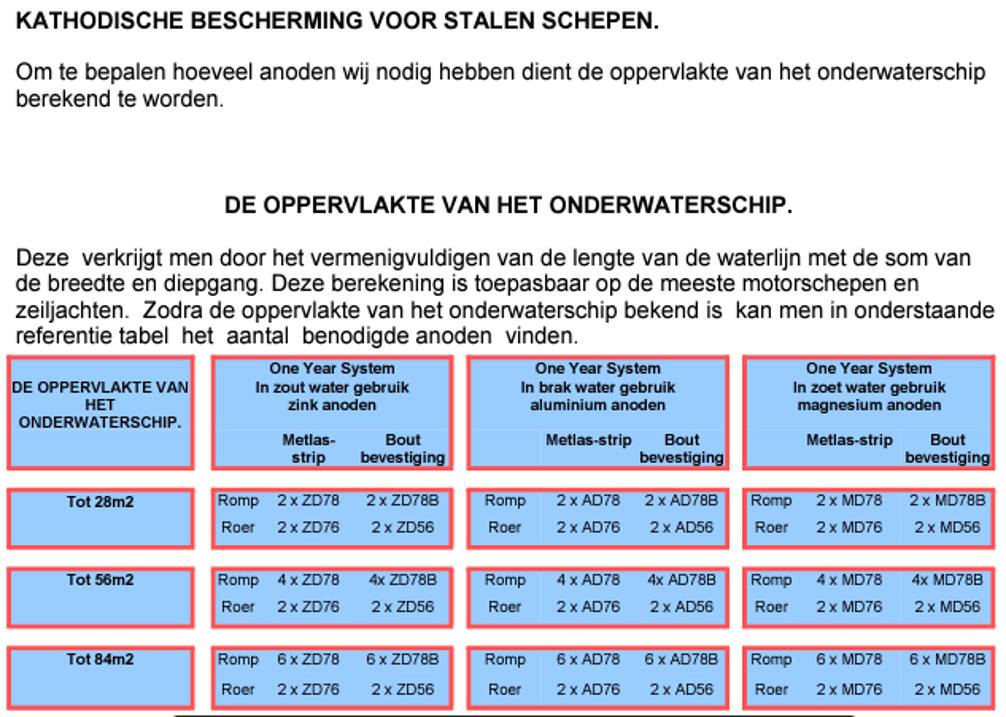
Welke anode kiezen

Verbruiken van ANODES

Uit wat bestaat een corrosie cel, een galvanische cel?
Om corrosie te doen ontstaan zijn er 4 elementen en een elektronen stroom nodig
ANODE
KATHODE
ELEKTROLYT
RETOUR CIRCUIT ( Belangrijk ! )
Hoe zit dit nu op een schip?
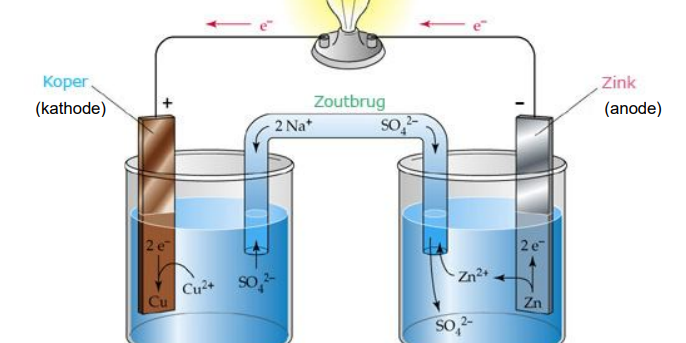
In de galvanische cel is een anode en een kathode met elkaar verbonden door een ZOUTBRUG. Het zeewater, brak, zoet of zout is de ZOUTBRUG van de galvanische cel. Het is een ionenoplossing.
In de ZOUTBRUG vloeien IONEN. Deze bouwen een electronendruk op in de zink anode en in de koper kathode, maar meer in de zinkanode.
De electronen moeten de anode kunnen verlaten door het maken van een electrische verbinding tussen de anode en de kathode. Dit kunnen koper draden zijn bij installatie, maar dit kan ook toevallig bilgewater zijn dat voor de geleiding zorgt tussen de aanwezige huiddoorvoeren.
Hierdoor wordt ZINK (aluminium, magnesium ) de oxidator en KOPER de reductor. Het ZINK zal uiteindelijk verdwijnen.
Professionele toepassingen met ICCP

Impressed Current Cathodic Protection
ICCP is cathodische bescherming gerealiseerd door een elektro chemische reactie tussen een MMO ( Mixed Metal Oxide ) Titanium anode en het te beschermen metaal door toevoeging van stroom.